Иммуноцитохимия
Иммуноцитохимическое исследование нередко является решающим в дифференциальной диагностике новообразований, когда при рутинном исследовании возникают непреодолимые трудности для установления гистогенеза отдельных опухолей, определения источника метастазирования, трактовки первично-множественных поражений.
За последние годы достигнут огромный прогресс в клиническом использовании различных биологических маркеров. В отличие от сывороточных маркеров, клеточные маркеры определяются непосредственно в опухолевых клетках ИЦХ исследованием, в основе которого лежит реакция антиген-антитело. В их числе онкогены, рецепторы эстрогенов и прогестерона, молекулы, опосредующие апоптоз, рецепторы факторов роста и т. д. Все эти показатели позволяют более детально изучить молекулярно-биологические особенности опухолевых клеток, ассоциированные со степенью дифференцировки, способностью к инвазии и метастазированию, чувствительностью к химиотерапии, и, следовательно, с особенностями течения и прогнозом заболевания в каждом конкретном случае.
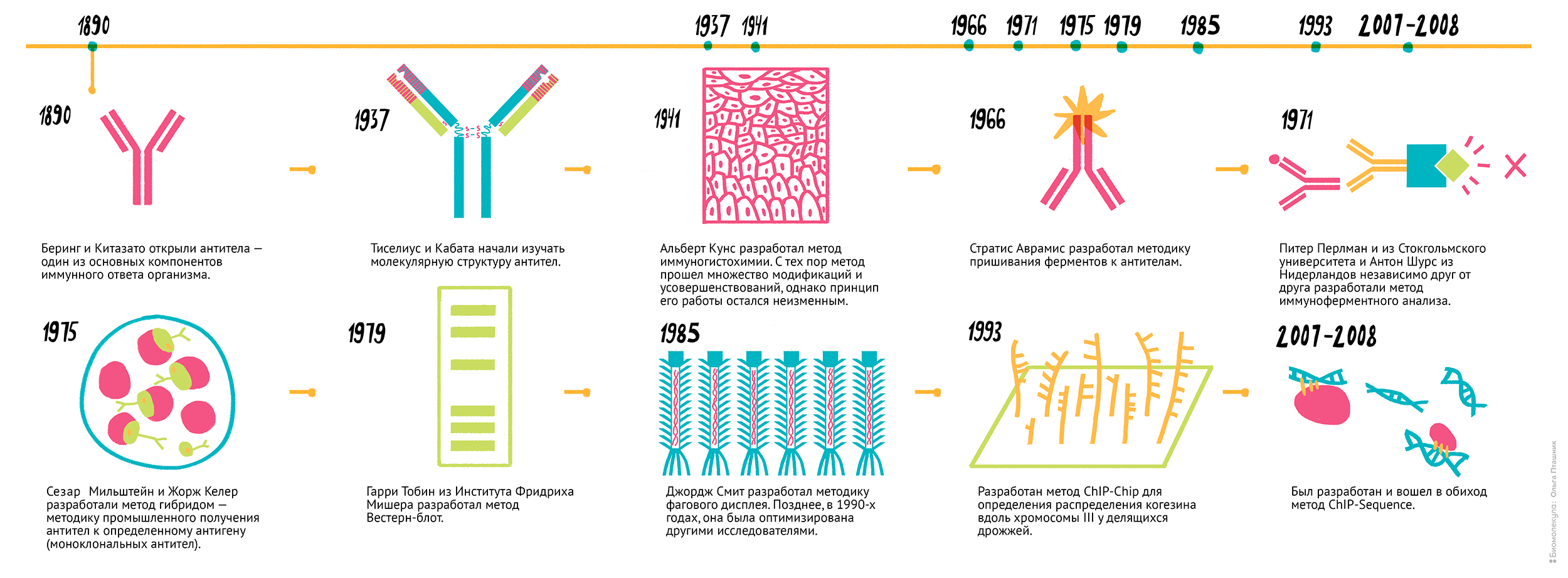
“В основе иммуноцитохимических исследований лежит реакция ваимодействия антитела и антигена. Антиген (antigen = antibody-generating — «производитель антител») — это любое чужеродное вещество, которое при попадании в ткани восприимчивого организма вызывает иммунный ответ, в результате которого формируются специфические антитела, которые затем связываются с данным веществом. Антигенами обычно являются высокомолекулярные белки и полисахариды, реже полипептиды, липиды и 4 нуклеиновые кислоты. Та часть молекулы антигена, которая соединяется с антителом, называется эпитопом или антигенной детерминантой.”
Специфических маркеров дифференциальной диагностики злокачественных и доброкачественных опухолевых процессов не существует, но на сегодняшний день активно ведутся научные изыскания в решении этой проблемы.
Разнообразие моноклональных антител, используемых в иммуноцитохимических исследованиях тонкоигольных пунктатов, в каждом конкретном случае позволяет ответить на вопрос, имеет ли данная опухоль эпителиальное происхождение или является саркомой, меланомой, лимфомой. Иммуноцитохимия широко применяется для иммунофенотипирования злокачественных лимфом, без чего, по современным канонам, невозможно начать лечение.
Иммуноцитохимическое исследование помогает в определении источника метастазирования при не выявленном первичном очаге. Иммуноцитохимическое исследование позволяет на дооперационном этапе установить важнейшие факторы прогноза опухолевого процесса и скорректировать схемы лечения. Пролиферативная активность многих новообразований оценивается с помощью антител Ki-67 в злокачественных лимфомах, опухолях молочной, предстательной, поджелудочной железы, легких, гипофиза, толстой кишки. Обнаружена связь между значениями индекса пролиферации и степенью гистологической дифференцировки опухоли, и клиническим прогнозом при раке эндометрия, яичников, легкого, молочной железы, мочевого пузыря, лимфомах, опухолях нервной системы.
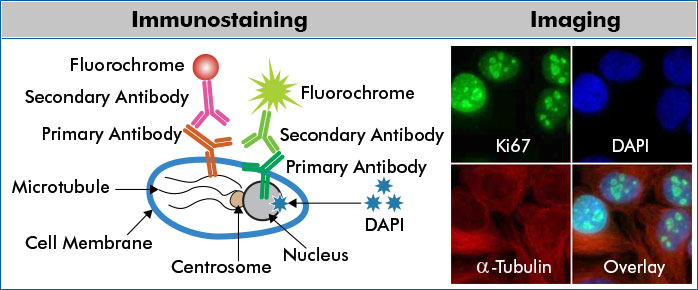
Иммуноцитохимические реакции оцениваются как качественно при уточнении гистогенеза опухоли, наличии метастаза в лимфатическом узле или другом органе, иммунофенотипировании лимфом, так и количественно – при оценке пролиферативной активности, экспрессии рецепторов гормонов в опухоли, онкопротеина С-erbB-2 и т.д. Иммуноцитохимическая реакция может быть ядерной, цитоплазменной и мембранной. Ядерная реакция проявляется интенсивным окрашиванием ядра и бывает при определении РЭ и РП, Ki67, PCNA, p53 и т.д. Цитоплазменная реакция характеризуется диффузным окрашиванием цитоплазмы или отложением гранул в виде грубых пятен и зерен. Цитоплазменное окрашивание дают хромогранин, синаптофизин, белок S-100, виментин, десмин, тиреоглобулин, кальцитонин, цитокератины, bcl-2 и т.д. Оценка этой реакции требует большой осторожности и контроля, так как фоновое окрашивание цитоплазмы клеток может быть принято за истинную реакцию. Мембранное окрашивание наблюдается при проведении реакции с онкопротеином C-erbB-2 и ЭМА (эпителиальным мембранным антигеном). Окрашивание в таких случаях только цитоплазмы не должно учитываться как экспрессия антигена. Маркер крупноклеточной анаплазированной лимфомы CD-30 может экспрессироваться как в цитоплазме, так и на мембране клетки.
“Впервые идея определения локализации молекул в тканях с помощью специфических флюорисцентных красителей, связанных с антителами была реализована в 40-е годы двадцатого века. Альберт Кунс использовал флюорисцентные соединения изоцианата для обнаружения пневмококка в печени мыши в 1941 году. В 1958 году Ригс в своей работе использовал флюорисцентный изотиоцианат (FITC) связанный с антителами. Эти работы стали первыми в мире работами по иммунологическому окрашиванию”
Использование иммуноцитохимического исследования позволяет расширить возможности морфологических методов и на дооперационном этапе уточнить гистогенез, диагностировать первично-множественные поражения, степень распространения и оценить некоторые показатели прогноза и чувствительность опухоли к химиогормонотерапии.
Несмотря на разнообразие моноклональных антител, используемых в иммунохимии – они едины для цитологии и гистологии1. Корреляция результатов экспрессии молекулярных маркеров при ИЦХ и ИГХ исследовании составляет от 61% до 92%2.
Значительную роль в развитии иммуноцитохимии сыграло внедрение метода жидкостной цитологии. Получение клеточной суспензии в транспортной среде позволяет приготовить серию равноценных препаратов для панели антител, приготовить клеточные блоки. Совместное применение ЖЦ и ИЦХ повышает точность результатов и чувствительность исследования. Так, например, комплексное использование метода ЖЦ с возможностью ИЦХ-исследования рецептивности эндометрия, определения панели маркеров хронического эндометрита и выявление ДНК возбудителя на малом объёме материала позволяет поставить морфологический диагноз ХЭ (специфичность 100%) на догоспитальном этапе3.
Метод клеточных блоков (cell-block technique) – это метод получения гистологических препаратов из цитологического материала. Cell-блоки позволяют проводить обзорные, селективные окраски, иммуноморфологические и молекулярно-генетические исследования, что существенно расширяет диагностические возможности цитологического метода. Преимуществом метода cell-блоков является возможность архивирования материала, получения серийных срезов, стабильный хорошо воспроизводимый результат при выполнении иммуногистохимических реакций (в отличие от иммуноцитохимических реакций, стандартизация которых ограничена). Морфологические характеристики клеточного материала в cell-блоках близки к гисто- и цитоструктуре гистологических препаратов.
Суть метода заключается в том, что клеточный материал получают теми же способами, как для традиционной и жидкостной цитологии из различных органов и тканей, а также из полостных образований. Путем центрифугирования пробы или получения очищенного клеточного осадка, как при автоматизированной жидкостной цитологии, получают осадок из клеток/фрагментов тканей, который помещают в связующую основу (тромбиновый сверток, агар и др.). В последующем материал обрабатывается так же, как биопсийный: фиксация, проводка, заливка в парафин, микротомия, окраска, заключение в монтирующую среду. Из одного блока можно приготовить серию микропрепаратов для постановки панели антител.
Полезные статьи:
-
Значение метода иммуноцитохимического исследования в диагностике предрака эндометрия (Дзюбий Т.И., Протасова А.Э., Раски Г.А., Цыпурдеева А.А., Тапильская Н.И.)
-
Роль молекулярных маркеров в дифференциальной диагностике фолликулярных опухолей щитовидной железы (Трошина Е.А., Мазурина Н.В., Абесадзе И.А., Юшков П.В., Гарбузов П.И.)
-
Expression of immunoreactivity and genetic mutation in eosinophilic and ciliated metaplastic changes of endometrial glandular and stromal breakdown cytodiagnostic implications (Keiko Shimizu, CTa, Yoshiaki Norimatsu, PhD, Tadao K. Kobayashi, PhD, Masami Sakurai, MD, PhD, Seiko Ogura, CT, Akihiko Yoshizawa, MD, Tomoyuki Miyamoto, CT, Yasuyuki Miyake, CT, Yatsuki Aratake, PhD, Takuya Sakaguchi, PhD, Eiji Ohno, PhD)
-
CellBlockistry Chemistry and art of cell‑block making – A detailed review of various historical options with recent advances (Vinod B Shidham, MD, FRCPath, FIAC)
-
Иммуноцитохимическое исследование цитологических препаратов жидкостной цитологии злокачественных плевритов и асцитов (Беляев А.М., Раскин Г.А., Захаренко А.А., Кондрацов С.А.)
-
Метод клеточных блоков в цитологической диагностике карцином печени (Сметанина С.В., Сметанина О.В.)
-
Преимущества иммуноцитохимического определения гормонального статуса, онкопротеина her2neu и белка пролиферативной активности ki67 у больных раком молочной железы (Савостикова М.В., Мехеда Л.В., Коротких И.Ю., Лактионов К.П.)
1 Глузман Д.Ф. с соавт. 2003, Петров С.В., Райхлин Н.Т. 2004
2 Глухова Е.И. 2003., Лукашина М.И. Афанасьева З.А. 2003 Bozetti C. et al 2004
